万用表/多用表电流表/钳形电流表电压表电源电能表校验装置无功功率表功率表电桥电能质量分析仪功率因数表电能(度)表介质损耗测试仪试验变压器频率表相位表同步指示器电阻表(阻抗表)电导表磁通表外附分流器 更多>>
流量检测仪表物位检测仪表记录/显示仪表机械量检测仪表温度检测仪表执行器显示控制仪表压力检测仪表过(流)程分析/控制仪表过程仪表阀门透视仪工业酸度计溶氧仪超声界面计校验仪仿真器其他工业自动化仪表 更多>>
检漏仪电火花检测(漏)仪超声检测仪其它探伤仪金属探测仪涂层检测仪其它硬度计测振仪频闪仪动平衡仪涂层测厚仪超声波测厚仪橡胶塑料测厚仪壁厚测厚仪塑料薄膜片测厚仪镀层测厚仪其它测厚仪维氏硬度计洛氏硬度计布氏硬度计 更多>>
类别:技术参数 出处:维库仪器仪表网 发布于:2018-04-12 11:05:19 | 8700 次阅读
为了对原子光谱与原子结构间的内在联系有一个形象化的理解,以氢原子为例,用图示的方式说明原子结构和原子光谱的关系。
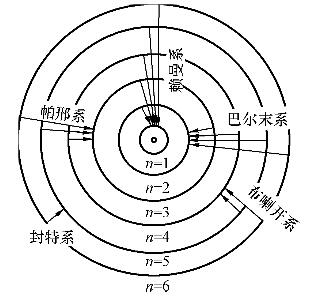
根据玻耳的假定和量子化条件,氢原子在不同的轨道上运动,其能量是不相同的。在正常情况下,它处于能量的n=1的轨道上。当原子受到辐射或高能粒子的碰撞等外界因素作用时,就吸收一定的能量而跃迁到某一个能量较高的状态上去。处于激发态的原子是不稳定的,电子能自发地过渡到能量较低的轨道,同时发出一个能量为hv光子,其波数可由式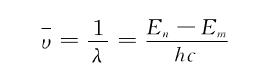 算出。原子从不同的较高能量的状态,过渡到同一能量较低的状态时所发生的单色光同属于一个线系。例如,从n=2,3,…轨道过渡到n=1的轨道所发射的谱线属于赖曼系;从n=3,4,…轨道过渡到n=2的轨道所发射的谱线属于巴尔末系,以此类推,见图。一个激发到第3玻耳轨道的电子,可以先从的轨道过渡到n=2的轨道,放出巴尔末系的第1条谱线,然后过渡到n=1的轨道,放出赖曼系的条谱线,也可以直接过渡到n=1的轨道,1个氢原子只能放出1条谱线,许多氢原子处于不同的激发态才能发出不同的谱线,通常在实验中都存在的大量不同能量的激发态原子,故可以同时观察到其全部发射光谱。
算出。原子从不同的较高能量的状态,过渡到同一能量较低的状态时所发生的单色光同属于一个线系。例如,从n=2,3,…轨道过渡到n=1的轨道所发射的谱线属于赖曼系;从n=3,4,…轨道过渡到n=2的轨道所发射的谱线属于巴尔末系,以此类推,见图。一个激发到第3玻耳轨道的电子,可以先从的轨道过渡到n=2的轨道,放出巴尔末系的第1条谱线,然后过渡到n=1的轨道,放出赖曼系的条谱线,也可以直接过渡到n=1的轨道,1个氢原子只能放出1条谱线,许多氢原子处于不同的激发态才能发出不同的谱线,通常在实验中都存在的大量不同能量的激发态原子,故可以同时观察到其全部发射光谱。
氢原子是所有元素的光谱中简单的光谱,在可见光区,它的光谱只由几根分立的线装谱线组成,其波长和代号见下表。
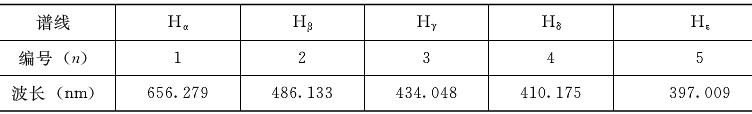
不难发现,从红到紫,谱线的波长间隔越来越小,n>5的谱线密得用肉眼几乎难以区分。
以上是关于氢原子的能级,电子较多的其他原子的情形与之基本相同,当然这些原子中具体情况要复杂的多,为了分析方便,常用不同高低的水平线表示不同的原子能量,用把两个能级连接起的线表示这两个能级之间发生跃迁时所辐射的谱线。
上一篇:电子水准仪采用自动电子读数的优点
下一篇:离子色谱经常检测的常见离子
凡本网注明“出处:维库仪器仪表网”的所有作品,版权均属于维库仪器仪表网,转载请必须注明维库仪器仪表网,http://www.hi1718.com,违反者本网将追究相关法律责任。
本网转载并注明自其它出处的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品出处,并自负版权等法律责任。
如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。